【特集:がんと社会】
後藤 励:がんの医療経済評価──抗がん剤の費用対効果評価を中心に
2025/07/07

医療技術の「承認」と「償還」
がん医療では、診断から予防、治療に至るまで日々新たな技術が開発されている。それらの技術を人々が使えるようになるまでは、どの国でも公的な規制がある。個別の医療技術について、人々がその効果や安全性について理解することが非常に難しいからだ。
公的な規制は大きく2つに分けられる。1つ目は「承認」である。医薬品や医療機器などの新たな技術は、その有効性や安全性が審査され、問題がなければ公的機関からの承認を受け市販される。2つ目は「償還」である。公的な医療制度や民間保険でその医療技術を支払うかどうかを判断し対価の支払いについても決める。
日本では、「承認」はPMDA(医薬品医療機器総合機構)、「償還」は厚生労働省が決定している。承認(薬事承認と呼ばれる)された医薬品のほぼすべてが公的医療保険で償還(保険適用と呼ばれる)されるため、2つの規制は事実上一体化している。
国外では、承認された医薬品が償還されないことも少なくない。米国は日本のような国民皆保険制度ではないため、公的な医療制度ではなく民間の医療保険に加入する場合も多い。個別の医薬品が償還されるかは、その人がどの保険に加入しているかによって大きく異なる。欧州などでは、日本と同じくそれぞれの国で統一された医療制度が運営されているが、医薬品の償還状況は国によって異なる。
その結果、抗がん剤であっても国によって患者が使用できる医薬品の種類は変わる。世界で製薬メーカーや新興企業による医薬品開発が最も盛んな国は米国である。米国で承認された医薬品のうち、各国で使用できるものはどの程度あるだろうか? 白岩(2025)では、2017年から2022年までに米国で承認された抗がん剤のうち、それぞれの国で流通しているものの割合が調べられている。その結果、ドイツ・英国で50~60%、日本で約40%、スイス・カナダで30~40%、オーストラリアで約30%、ニュージーランドで約10%であった。海外で承認された医薬品が日本で使えないことが問題視されることもあるが、米国では加入する保険によって使えるかどうかが違い、その他の国でも国によって使えるかどうかが異なるため、いずれにしても全ての医薬品が使えるというわけではない。
承認されたとしても公的医療制度で償還されなければ、自費で全額払うかその薬を償還する民間保険に加入する必要がある。このように、多くの国民がある薬剤を使えるかどうかは、償還の意思決定が重要となる。
医療技術評価(HTA)とは
「承認」と「償還」はそれぞれの役割や評価するポイントが異なっている。図1のように「承認」では、その医療技術が安全で健康改善効果があるのかについて評価される。一方の「償還」は自費であっても使用できるかどうかを判断する「承認」と比べ、公的制度や民間保険という皆から集めたお金をどのように使うべきかを判断する。そのため、その技術にお金を使う価値があるのかどうかや財政全体への影響など、医療経済面での評価が必要となる。
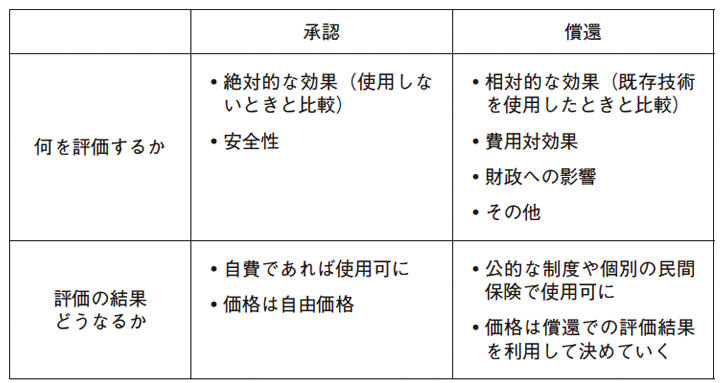
また、健康改善効果についても、「承認」では新しい技術そのものの絶対的な効果が重要となるが、「償還」ではこれまで使っていた技術と比べた相対的な効果が重要となる。使用しないときに比べて使用した時に安全で健康改善があれば「承認」されるが、「償還」では既存技術を使用したときに比べてより健康改善が得られるかどうか、さらにそれが費用に見合うかどうかが重要となる。
したがって、「承認」に比べ一般的には「償還」の方がハードルは高くなる。薬事承認された医薬品のほぼ全てが保険適応される日本の制度は、医薬品への公平なアクセスという点では優れた制度と言える。
医療経済面の評価をどのように政策の中で実装しているかについては国によってかなり異なる。個別の医療技術の相対的な効果の評価や費用対効果などの医療経済面の分析などの医療技術価値の評価、そして評価結果を用いた政策上の意思決定を含めたプロセス全般を、医療技術評価(Health Technology Assessment: HTA)と呼ぶ。
医薬品等の費用対効果評価
日本では、2019年4月より医薬品等の費用対効果評価が始まった。それまでも、新薬についてはその公定価格である薬価を決める際に既存薬と比較して薬価を決定する制度はあった。したがって、「承認」と異なる観点での評価を「償還」段階で行うというHTAは部分的に行われていたと言ってもよい。しかし、これまで費用対効果を明示的に評価して意思決定に組み入れることはなかった。
現在、医薬品などの中で、市場規模などに基づいて選ばれたものの費用対効果を検討し、その結果を公的価格の調整に用いている。他国のように、費用対効果を償還の可否そのものに用いていないのが日本の制度の特徴である。これまでの医療制度との整合性と新しい医療技術のアクセスへの公平性を重視した制度と言える。
慶應義塾大学では制度化と軌を一にして、2019年から大学院健康マネジメント研究科において、費用対効果評価をはじめとした医療技術の経済評価に携わる人材育成事業を受託した。さらに2020年からは、医学部において医薬品等の評価を実際に行う公的分析事業を受託している。
制度化されて6年余りが経ち、50を超える品目の評価が行われている。2024年度に評価が始まった10品目のうち、7品目は抗がん剤であった。
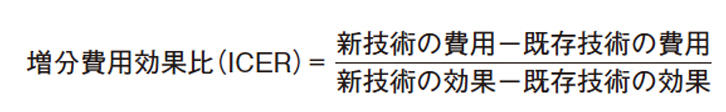
費用対効果の指標として世界的に使われているのは、増分費用効果比(Incremental Cost-Effectiveness Ratio: ICER)と呼ばれ上の式で表すことができる。
ICERは効果の改善につき追加にどれくらい費用がかかるかの指標であるため、ICERが大きくなればなるほど新しい医療技術の費用対効果が悪いということになる。このように、ICERを用いることで新しい医療技術の費用対効果を数量的に評価することができる。
効果の指標については、できるだけ幅広い医療技術を同じ効果指標で比べられるようにQALY(質調整生存年)といって、QOL(生活の質)と生存期間の両方を考慮した指標を用いる。1QALYは完全な健康での1年の生存となるので、ICERは完全な健康で1年生存が延びるために追加でかかる費用という意味を持つ。
どの程度のICERまで費用対効果がよいと考えるかが非常に問題であるが、日本で費用対効果がよいと判断される目安はICERが500万円/QALYまでとされている。現在の費用対効果評価でも、この金額が使われているが、抗がん剤や小児が適応に含まれるものなど配慮が必要だとされている品目の場合は、750万円/QALYが使われている。
これまで評価が終わった抗がん剤は7品目あった。同じ抗がん剤でもがんの種類や治療のタイミング、比較する既存治療などが異なり費用対効果が異なる場合がある。全部で16ケースのうち、費用対効果がよかった、つまりICERが750万円/QALY未満だったケースは11(69%)だった。そのうち2ケースでは既存治療と比べ効果が高く、費用も削減される、つまり非常に費用対効果がよいという結果であった。一方、費用対効果が悪かった、つまりICERが750万円/QALY以上だったのは5ケース(31%)だった。ちなみに、既存治療より効果が劣るものはなかった。
日本ではこの結果は公的価格の調整に使われる。費用対効果が悪かったとしても、公的保険で使えなくなることはない。公的価格が引き下げられた場合は、患者さんにとっては薬剤の自己負担も下がる可能性があるため、医療現場も混乱はなさそうである(長期的には、価格が引き下げられることで開発インセンティブが減り新しい技術が開発されにくくなるという可能性はある)。
医療経済評価を今後どう使うか?
医療でも費用対効果を考えるという発想は、筆者が大学院に入学した25年前と比べると格段に受け容れられている。医薬品等の費用対効果評価については、2010年頃から政策的な議論が始まり、約10年の準備期間の後に開始された。まず、医療経済評価の方法論について国内の研究者間で学術的なコンセンサスを得て、質の高い医療経済評価研究を行うための方法論がガイドラインとしてまとめられた。2016年度には7つの薬剤と6つの医療機器に対して費用対効果の試行的導入が行われた。このように制度化にあたり慎重な検討が行われ、政策応用についても償還そのものの可否を決めるのではなく、公的価格の調整に用いることとなった。
今後より一層の医療費の効率化が必要となったときはどのようにすればよいのだろうか? 抗がん剤の費用対効果評価ではなかったケースだが、既存治療と比べて効果の改善がないという場合、費用がより安い治療を積極的に使うことについては、ジェネリックの推進などですでに行われており、抵抗は少ないだろう。実際に抗がん剤でも効果が同等であれば、休薬や減薬による費用削減が可能かについて研究が進められている。
既存治療に比べて効果は改善するが費用が高い場合、その償還の可否について費用対効果を考慮して決めるということについては、専門家の技術的な議論だけでは導入は難しい。たとえば、費用対効果がよいとされる目安は500万円/QALYで本当によいのだろうか? 抗がん剤は750万円/QALYとして、他の病気より費用対効果が優れていないことをある程度許容されているが、他にも考慮が必要な疾患はあるだろうか?
費用対効果評価制度導入時にもこれらは医療に関するステークホルダーが集まった政府の会議体で時間を立てて議論された。しかし、今後医療経済評価をより積極的に医療の資源配分に活用することになると、専門家と患者、保険料や税を支払う一般の人々を巻き込んだ議論を他国と同様に行う必要があるだろう。
〈参考文献〉
* 白岩健(2025)「「開発され過ぎる」問題と「されなさ過ぎる」問題:あるいはローカルドラッグとドラッグ・ラ グに関する研究」『医療経済研究』36(2)
※所属・職名等は本誌発刊当時のものです。
2025年7月号
【特集:がんと社会】
- 1
| カテゴリ | |
|---|---|
| 三田評論のコーナー |

後藤 励(ごとう れい)
慶應義塾大学大学院経営管理研究科教授/健康マネジメント研究科委員